
新股消息 | 康诺亚生物递表港交所主板,公司的产品尚未获准进行商业销售

4 月 8 日披露,康诺亚生物医药科技有限公司向港交所主板申请上市,大摩、中金公司、华泰国际为其联席保荐人。
智通财经 APP 获悉,据港交所 4 月 8 日披露,康诺亚生物医药科技有限公司 (以下简称 “康诺亚生物”) 向港交所主板申请上市,大摩、中金公司、华泰国际为其联席保荐人。

康诺亚生物是一家生物科技公司,拥有多种临床阶段的资产,每种资产均为其各自竞争领域中的有力竞争者。公司专注于自主发现及开发创新生物疗法以满足自体免疫及肿瘤治疗领域中未获满足的大量医疗需求。
公司的核心业务模式是基于差异化或经临床验证的作用机制自行发现及开发创新疗法。为配合内部研发工作,公司亦通过合资企业或对外授权安排与第三方合作开发及商业化公司的候选药物。招股书显示,公司和多个知名药企展开合作,其中包括石药集团 (01093)、乐普生物、天广实、诺诚健华 (09969)。
公司产品
公司目前研发中的产品及对已进入临床阶段的候选药物及选定的可进入临床试验申请阶段的候选药物开发状态:
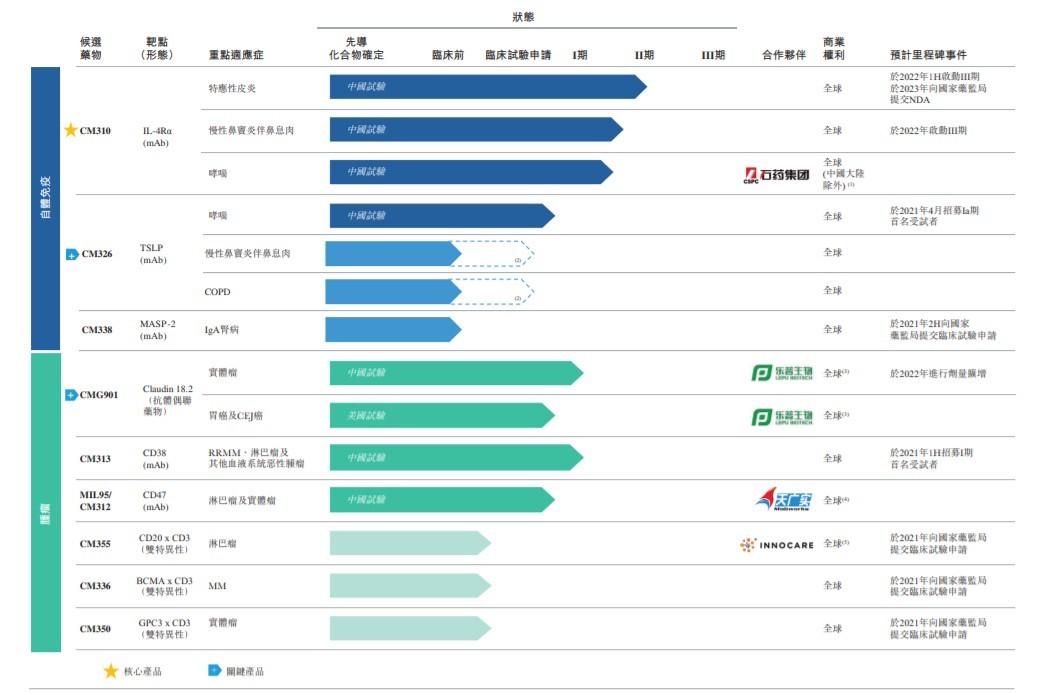
公司的核心产品为 CM310(IL-4Rα抗体),是多种临床试验中的一种针对白介素 4 受体α亚基 (IL-4Rα) 的人源化及高效的拮抗剂抗体。其为首个国产且获得中国国家药品监督管理局 (国家药监局) 的临床试验申请批准的 IL-4Rα抗体。通过靶向 IL-4Rα,CM310 阻断白介素 4 (IL-4) 及白介素 13 (IL-13) 的信号传导。IL-4 及 IL-13 为引发 II 型炎症的两种关键细胞因子。
公司的主要候选药物包括 CM326(TSLP 抗体) 和 CMG901(Claudin 18.2 抗体偶联药物)。其中,CM326 是针对胸腺基质淋巴细胞生成素 (TSLP) 的人源化高效单克隆抗体。其为中国首个全世界第三个获临床试验申请批准的国产 TSLP 靶向抗体。CMG901 是靶向 Claudin 18.2 的抗体偶联药物,含 Claudin 18.2 特异性抗体、可裂解连接子及毒性载荷单甲基澳瑞他汀 E (MMAE)。其为首个在中国及美国取得临床试验申请的 Claudin 18.2 抗体偶联药物。
财务状况
招股书显示,康诺亚生物的产品尚未获准进行商业销售,因此尚未从产品销售中产生任何收入。自公司成立以来,公司每年产生经营亏损。于 2019 年及 2020 年,公司分别产生全面亏损总额 1.68 亿元及 8.19 亿元。全面亏损总额主要来源于研发开支、行政开支及可转换可赎回优先股公允价值亏损。
公司预期在至少未来几年经营开支会增加,因为公司需要进一步进行临床前研究、继续进行候选药物的临床开发、就候选药物寻求监管批准及制造候选药物、推出的在研产品以及增聘必要人员以经营公司的业务。

募资用途
(1) 约 40% 的资金将用于正在进行及计划开展的临床试验,筹备公司的核心产品 CM310(IL-4Rα抗体) 的注册备案及计划开展的商业化上市;
(2) 约 10% 的资金将通过对公司与乐普生物的合资企业 KYM 进行注资而将用于正在进行及计划开展的 CMG901 (Claudin 18.2 抗体偶联药物) 临床试验,包括但不限于正在中国进行的晚期实体瘤 I 期临床试验;
(3) 约 10% 的资金将用于正在进行及计划开展的临床试验来评估 CM326(TSLP 抗体) 治疗哮喘患者,包括但不限于 la 期的健康对象:
(4) 约 15% 的资金将用于公司其他管线产品的临床前评估及临床开发,包括 CM313(CD38 抗体)、MIL95/CM312 (CD47 抗体)、CM338(MASP-2 抗体)、CM355(CD20xCD3 双特异性)、 CM350(GPC3xCD3 双特异性) 及 CM336(BCMAxCD3 双特异性)。
(5) 约 15% 的资金将用于公司新生产及研发设施的租赁付款,及购买机械及设备。公司预计在 2022 年完成第一阶段新商业化规模生产设施,预计将为公司提供 16,000L 的额外产能。
(6) 约 10% 的资金将用于公司的一般企业及营运资金用途。
