
與輝瑞 Paxlovid 頭對頭!君實新冠口服藥 VV116 新開 3 期臨牀 | 見智研究

該方案充分滿足了臨牀倫理,也體現了君實對 VV116 的信心。
4 月 19 日,中國臨牀試驗註冊中心文件顯示,上海市瑞金醫院申請註冊了《一項評價 JT001(VV116)對比 Paxlovid 早期治療輕 - 中度新型冠狀病毒肺炎(COVID-19)有效性和安全性的多中心、單盲、隨機、對照臨牀研究》。
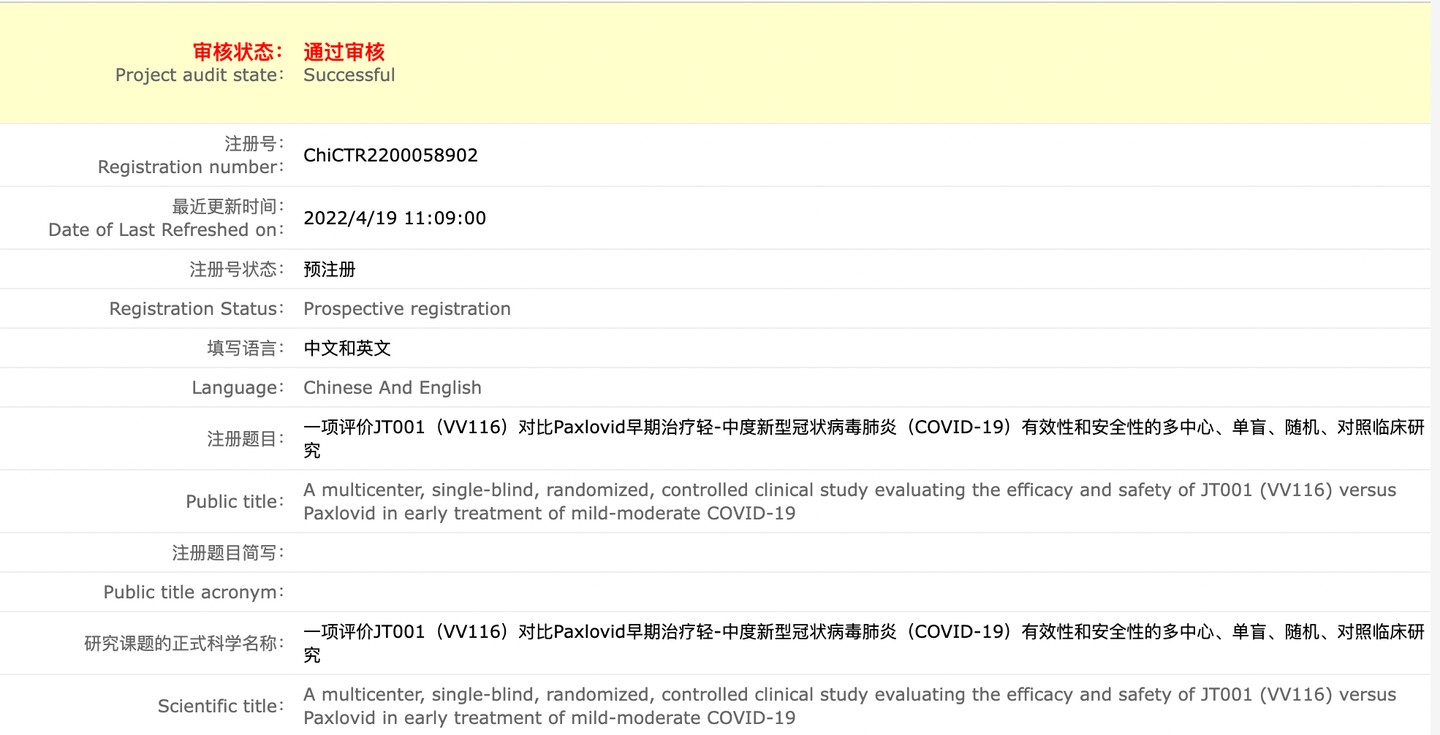
此次研究將入組 480 例患者,使用 VV116 與 Paxlovid 各 240 人,3 期臨牀試驗從 2022 年 4 月 1 日至 2022 年 12 月 31 日。入組人員為有基礎疾病的,且症狀評分≥2 分的新冠確診病人。試驗地點為上海市瑞金醫院。
華爾街見聞·見智研究認為,由於目前上海新冠疫情,該臨牀會快速實現全部入組,且目前該臨牀已開始入組。

在臨牀註冊文件中,此次研究目的共有 5 項:
1、評價 JT001(VV116)與 Paxlovid 相比對總體受試者臨牀狀況的影響
2、評價 JT001(VV116)與 Paxlovid 相比安全性特徵
3、評價 JT001(VV116)與 Paxlovid 相比截至第 28 天 COVID-19 臨牀變化
4、評價 JT001(VV116)與 Paxlovid 相比截至第 14 天的 SARS-CoV-2 的變化
5、評價 JT001(VV116)與 Paxlovid 相比截至第 10 天胸部 CT 掃描的變化
該臨牀試驗的主要指標為
1)至持續臨牀恢復的時間(截至第 28 天)
2)截至第 28 天發生 COVID-19 進展(定義為進展為重度/危重 COVID-19 或全因死亡)的受試者百分比。

見智研究認為,由於 Paxlovid 已獲緊急批准進入《新型冠狀病毒肺炎診療方案(試行第九版)》,成為新冠指南推薦用藥,此次 VV116 選擇頭對頭 Paxlovid 進行臨牀,也充分符合滿足病人臨牀緊急需求的倫理要求,使得有基礎疾病的高風險新觀患者能夠獲得有效的治療。同時也體現了君實/旺山旺水對該產品療效的信心。
VV116 由中國科學院上海藥物研究所、中國科學院武漢病毒研究所、旺山旺水生物醫藥有限公司聯合研發,2021 年 9 月,君實生物與旺山旺水達成合作協議之後共同承擔 VV116 在全球範圍內的臨牀開發和產業化工作。
Paxlovid 是 3CL 蛋白酶抑制劑 nirmatrelvir 與低劑量利托那韋 (Ritonavir) 的複方製劑,由 300mg(兩片 150mg 片劑)的 nirmatrelvir 和一片 100mg 的利托那韋片進行組合給藥供新冠患者口服,每日給藥 2 次,持續 5 天。目前 Paxlovid 已獲得中國藥監局附條件緊急批准使用,用於治療成人伴有進展為重症高風險因素的輕至中度新型冠狀病毒肺炎 (COVID-19) 患者,並進入新冠治療手冊第九版。
此外,君實在 1 月 26 日公告,與旺山旺水共同開發靶向 3CL 蛋白酶的可口服抗新冠病毒候選新藥 VV993,該靶點與輝瑞新冠口服藥相同。同時公司還宣佈 VV993 未來可能將與 VV116 聯用,發揮更大效果。


